Em 6 de novembro de 2019, a Diretoria Colegiada da Agência Nacional de Vigilância Sanitária publicou a Resolução RDC 318. Seu objetivo foi estabelecer os critérios para a realização de estudos de estabilidade de insumos farmacêuticos ativos (IFAs) e medicamentos novos e inovadores, exceto biológicos.
Por meio da RDC 318, é possível garantir que o medicamento mantenha sua estabilidade ao longo de todo seu prazo de validade. Ou seja, ele terá de apresentar os mesmos resultados ao ser prescrito ao paciente, tal qual tinha quando saiu da fábrica.
Composta por 118 artigos e dois anexos, a RDC 318 se tornou o principal guia a ser seguido pelas empresas para garantir a estabilidade dos insumos farmacêuticos ativos. Além disso, sua criação permite que as empresas brasileiras sigam padrões internacionais de estabilidade para IFAs.
Da mesma forma, a publicação de regras claras e rígidas sobre estabilidade permitiu à Anvisa integrar o ICH (International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use). Ele é o Conselho Internacional sobre Harmonização de Requisitos Técnicos em Produtos Farmacêuticos para Uso Humano.
O que é a RDC 318?
Antes de aprofundar o conhecimento em torno dessa resolução da Anvisa, vamos detalhar o que ela é, de fato. Para sua criação, a Agência Nacional de Saúde percorreu um longo caminho de análise, estudos e discussão com a sociedade sobre a estabilidade de insumos farmacêuticos. Para isso, foram realizadas consultas e audiências públicas, que resultaram na publicação da normativa.
Esse novo marco regulatório colocou todos os medicamentos fabricados e comercializados no Brasil no mesmo padrão de qualidade e conformidade internacionais. A RDC 318 estabeleceu critérios técnicos para os estudos de estabilidade dos IFAs, sejam medicamentos novos, similares, genéricos, inovadores, dinamizados, específicos, ou de notificação simplificada.
Entre as mudanças que a resolução da Anvisa promoveu foi:
1. Detalhamento dos estudos
Maior detalhamento dos estudos, tanto nas informações de protocolos quanto nos relatórios anexos. Isso permite maior rigor nas variações permitidas em cada ensaio.
2. Testes adicionais
A necessidade de estudos e testes adicionais, visando maior controle de antimicrobianos e antioxidantes em todos os pontos de estudo de insumos farmacêuticos.
3. Estudos de temperatura
A RDC 318 também requer estudos de congelamento no caso de materiais refrigerados, e também estudos sobre temperaturas superiores no caso de materiais congelados.
4. Frequências adicionais
Também exige a realização de frequências adicionais de estudos, sobre uso, reconstituição e diluição, seja no início ou no fim, e qual o ponto de submissão da petição.
5. Controles adicionais
Por fim, a resolução determina o preenchimento de dados e controles adicionais, com apresentação de estudos de longa duração de, no mínimo, 12 meses, para moléculas novas. Além disso, a apresentação de avaliação estatística nos casos de validade provisória.
O que é estabilidade do medicamento?
O termo estabilidade do medicamento refere-se à extensão em que um insumos farmacêuticos ou produto retém, dentro de limites especificados e ao longo de seu período de armazenamento e uso.
Ou seja, ele deve manter as mesmas propriedades e características que possuía no momento de sua fabricação. O tipo de estabilidade é geralmente dividido em química, física, microbiológica, terapêutica e toxicológica.
Pode ainda ser categorizada como estabilidade pré-comercialização e produto comercializado. No caso da pré-comercialização, ela dá suporte ao ensaio clínico em que os medicamentos são armazenados em diferentes condições para avaliação de segurança e eficácia. Em geral, é realizada durante o ensaio clínico.
A estabilidade comercial é uma garantia contínua nos lotes pós-aprovação para monitoramento de longo prazo do medicamento. A avaliação geralmente envolve o teste da substância ou produto medicamentoso usando um método indicador de estabilidade, a fim de estabelecer o período de reteste (para pré-comercialização) e prazo de validade.
Substância medicamentosa, também chamada de insumos farmacêuticos ativos (IFAs) é o material que é usado para fabricar, geralmente com excipientes, o medicamento. As substâncias medicamentosas podem ser derivadas de síntese química, fontes vegetais ou animais, ou tecnologia biológica ou recombinante.
Além dos IFAs, a substância medicamentosa pode conter impurezas ou substâncias relacionadas ao produto e ao processo. Desde o estágio inicial do desenvolvimento do medicamento, as informações sobre a estabilidade têm sido parte integrante do desenvolvimento.
Os dados sobre as características físicas e químicas e outras propriedades do fármaco são úteis para projetar métodos e também para projetar estudos formais.
Quais os parâmetros interferem na estabilidade?
A estabilidade de medicamentos é um elemento crítico para a validação de métodos de bioanálise. Dessa forma, é fundamental compreender os fatores mais comuns que afetam a estabilidade, a fim de desenvolver métodos adequados para sua detecção e medição.
A degradação de medicamentos em amostras pode ocorrer por processos reversíveis ou irreversíveis. Os fatores comuns que afetam essa estabilidade incluem:
- Temperatura
- Luz
- pH
- Oxidação
- Degradação enzimática
Considerações especiais também são necessárias ao lidar com moléculas quirais, padrões internos deuterados e grandes biomoléculas. Importante lembrar que qualquer degradação pode causar alterações na estrutura do princípio ativo, reduzindo sua atividade terapêutica ou causando efeitos indesejados, devido à formação de produtos tóxicos.
Quais são os testes realizados?
Para garantir a estabilidade dos insumos farmacêuticos, a RDC 318 determina uma frequência de testes, seguindo protocolos previstos, e que devem ocorrer entre o terceiro e o sexto mês de estudo. Nesse período, deve ser analisado:
- Aspecto
- Teor
- Quantificação de produtos de degradação
- Dissolução ou teste de desempenho do produto, a depender da forma farmacêutica
- pH
- Quantificação de antimicrobianos e antioxidantes
Nos casos de medicamentos que contenham IFA vegetal ou opoterápido, além dos testes listados acima, é necessário testar a desintegração do insumo. Já no caso de medicamentos dinamizados, é exigido o teste de desintegração e umidade, quando aplicáveis à forma farmacêutica.
A resolução da Anvisa ainda determina que, para os estudos de estabilidade de longa duração, os mesmos testes listados acima deve ocorrer considerando vários períodos, como:
- Logo após a fabricação
- A cada três meses durante o primeiro ano
- A cada seis meses durante o segundo ano
- Anualmente a partir do terceiro ano do prazo de validade proposto
Outro teste previsto recomendado pela Anvisa é o chamado Estudo de Fotoestabilidade. Nele, é necessário fazer o estudo do medicamento fora de sua embalagem e completamente exposto a uma fonte de luz. Caso não ocorram resultados fora da especificação, ele será considerado fotoestável.
Caso contrário, o estudo deve ser conduzido na embalagem primária e exposto à mesma condição de luz. Se ele não apresentar alterações em suas especificações nesse modelo de teste, será considerado fotoestável desde que mantido em sua embalagem original.
A tecnologia como aliada na aplicação da RDC 3018
A estabilidade do medicamento está diretamente ligada à sua conservação de acordo com a recomendação do fabricante. A temperatura, por exemplo, pode ser diferente, de acordo com o IFA utilizado. Porém, para garantir sua estabilidade, é necessário que não ocorra oscilação na temperatura, sob pena de inviabilizar o uso do medicamento.
Dessa forma, usar ferramentas tecnológicas de controle e monitoramento da temperatura é essencial para as empresas ligadas à área farmacológica. Isso garante que a temperatura de conservação será mantida ao longo de todo o processo, evitando a degradação e garantindo a eficácia do medicamento quando administrada ao paciente.
Nesse sentido de controle de temperatura, a própria RDC 318 da Anvisa no qual apresenta em seus anexos as temperaturas recomendadas para armazenamento e condições de realização de estudo de estabilidade de longa duração.
As tabelas são separadas em condição de armazenamento, Estudo de Longa Duração ou de Acompanhamento e Estudo de Estabilidade Acelerado. Em cada uma delas, consta a temperatura indicada para cada tipo de situação. Confira abaixo a tabela para medicamentos.
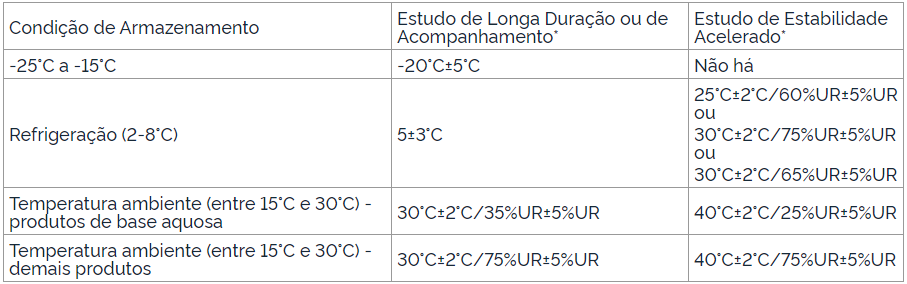
Fonte: RDC Nº 318, Anvisa.
Ou seja, é necessário seguir os parâmetros internacionais da Cadeia do Frio para manter a estabilidade do medicamento e de insumos farmacêuticos.
Além disso, quando se fala em RDC 318, é fundamental ainda seguir diretrizes gerais de segurança para garantir a estabilidade dos medicamentos. E é sobre esse assunto que abordamos neste outro artigo postado no blog. Clique aqui e amplie seu conhecimento!